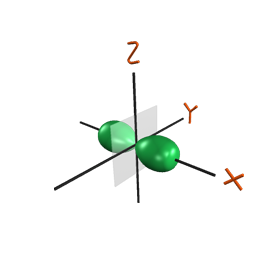
Atomic Orbitals คือ การกระจายตัวของความน่าจะเป็น (Probability Distribution) ของอิเล็กตรอนใน Atom สามารถเรียกอีกชื่อหนึ่งว่า Electron Orbitals ก็ได้ แต่เนื่องจาก Electron Orbitals เมื่อพิจารณาระดับโมเลกุล จะกลายเป็น Molecular Orbitals ดังนั้นเพื่อไม่ให้สับสนจึงใช้เป็น Atomic Orbitals
Atomic Orbitals แทนปริมาตรของ Space ซึ่งภายในปริมาตรนี้ อิเล็กตรอนจะมีความน่าจะเป็นที่แน่นอนค่าหนึ่งซึ่งขึ้นกับ Energy States และ อะตอม เช่น ใน Energy State ที่มีพลังงานต่ำสุดของ Hydrogen Atom อิเล็กตรอนจะถูกพบภายในทรงกลมที่ล้อมรอบนิวเคลียสของอะตอม ส่วนในระดับพลังงานที่สูงขึ้น Atomic Orbitals จะมีรูปแบบที่แตกต่างกันออกไป เช่น อาจมี Lobes หรือ Rings เป็นต้น รูปแบบของ Atomic Orbitals ขึ้นกับองค์ประกอบมาก องค์ประกอบที่สำคัญที่สุดคือ Quantum Numbers ที่สอดคล้องกับ Energy State ซึ่งได้แก่ Principal Quantum Number (n), Orbital Quantum Number (l) และ Angular Momentum Quantum Number (m) รูปทรงต่างๆ จะขึ้นอยู่กับระดับพลังงานของอิเล็กตรอน การใช้ทฤษฎีควันตัม จะสามารถอธิบายการจัดเรียงตัวของอิเล็กตรอนรอบนิวเคลียส ได้ว่าอิเล็กตรอนจัดเรียงตัวเป็นออร์บิทัล(orbital) ในระดับพลังงานย่อย s , p , d แต่ละออร์บิทัล
Download